哺乳动物细胞瞬时转染能在短期内快速表达高活性蛋白而被广泛应用。本文主要介绍了细胞瞬时转染的步骤、原理,及血球计数板对细胞计数的原理和方法。哺乳动物细胞自身具有蛋白折叠和翻译后修饰的功能,获得的蛋白更具有天然活性。哺乳动物细胞生产蛋白的方式有两种:瞬时转染和稳定转染。瞬时转染的特点是短期快速表达,满足蛋白的小量制备。而稳定转染通过构建稳定细胞系能够满足蛋白的大量、长期生产。
瞬时转染是指将构建好的质粒通过某种方式导入到哺乳动物细胞内(主要指HEK293细胞),该质粒上的外源基因不整合到细胞自身的基因组上。随着细胞的生长分裂,外源基因会逐渐丢失。质粒在细胞内能够存在3-4天,此时间内,质粒外源基因在细胞内发生转录翻译,得到极为少量的蛋白。这一整个快速转染得到蛋白的过程就称为瞬时转染表达。
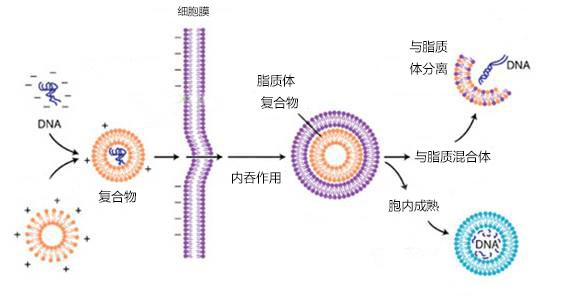
瞬时转染流程简图
细胞复苏是将保存在液氮或-80℃冰箱中的细胞株解冻并重新培养的过程。细胞复苏的关键是快速。防止在解冻过程中,产生的水珠形成冰晶损伤细胞。细胞复苏一般步骤如下:
细胞复苏后,生长一段时间,95%的细胞贴壁生长,细胞状态良好,说明细胞复苏成功。
以Lipofectamine转染试剂为例的操作流程,不同转染试剂参考说明书
收集培养的细胞,采用超声或酶解的方法破碎细胞,离心得到上清。转染后的检测主要包括基因水平和蛋白水平的检测。针对基因水平,使用普通PCR或RT-PCR进行验证。蛋白水平,使用western blot检测。
细胞计数的原理就是测定单位体积内细胞的数量从而得到细胞总浓度,在细胞培养和测定细胞生长曲线的过程中广泛应用。本实验是采用血球计数板对细胞计数,步骤如下:
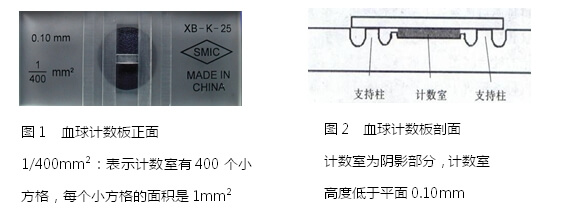
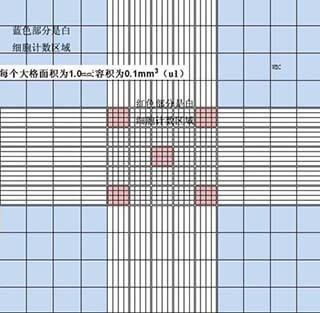
图3 血球计数室表面
每个血球计数板有上下两个计数室(如图1)
每个计数室分为九大格(如图3)
其中最中间的方格分为25个中格,每个中格又被分为16个小格,因此计数室中一共有400个小格。每次计数时选取图3中红色部分计数,计数结果乘以5得到一个计数室中总的细胞个数

亚美体育·(中国)在线登录 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策