GST pull down实验流程
本文主要介绍了GST pull-down实验的服务流程(数据以实际实验为准)
GST蛋白的表达
- 将表达GST融合蛋白的质粒转入BL21大肠杆菌菌株中;
- 挑单克隆于3ml LA(LB+Amp)培养基中,37℃摇菌过夜,获得种子液;
- 将种子液稀释于50ml 2x YT A(YTG+Amp)培养基中,使起始OD600为0.1;
- 28℃,220rpm摇菌培养2小时 ;
- 加入50μl 100mM IPTG,16~27℃摇菌培养1~8小时;
- 收菌,将菌液倒入大离心管,2管/50ml菌液,4℃ 5000rpmx5min离心,弃上清;
- 加入10ml PBS/管,重悬细胞,5000rpm离心5min,弃上清;
- 超声破壁,将裂解液分入1.5ml离心管中,4℃离心12000rpm×10min,取上清;
- 吸取少量上清,加入蛋白电泳上样缓冲液,在沸水中煮3min,离心(12000rpm,1min),取上清SDS-PAGE电泳,检测表达情况;
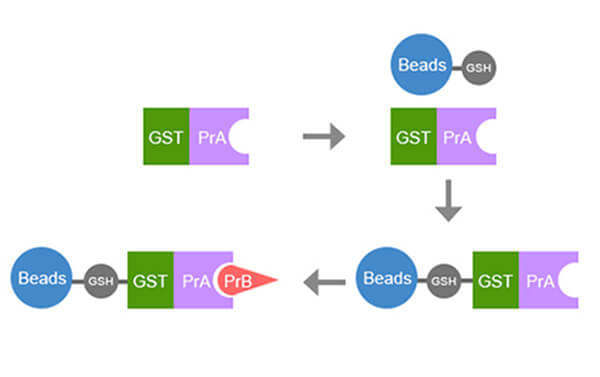
gst pull down 实验流程
准备50% GST琼脂糖凝胶
- 将原75%谷胱甘肽琼脂糖凝胶的浆液弹至混匀;
- 取677μl原液/管,3000rpm离心5min,弃上清;
- 加500μl PBS,颠倒混匀,3000rpm离心5min,弃上清,反复5次;
- 加500μl PBS,颠倒混匀,配成50%谷胱甘肽琼脂糖凝胶备用;
GST蛋白的纯化
- 在新鲜制备的细胞裂解液上清中加入20μl 50%谷胱甘肽琼脂糖凝胶4B,4℃,摇床上摇,反应30min~60min;
- 3000rpm离心5min,弃上清;该琼脂糖凝胶上即结合了GST融合蛋白,(如果仅仅是做纯化效果检测或者蛋白表达量很高,可以只接合一次,如果要结合更多则接着往下做);
- 在管中加入离心后的1.5ml新鲜制备的细胞裂解液的上清,4℃,反应30min~60min。3krpm离心5min,弃上清。重复该步骤多次,就可以使琼脂糖凝胶上结合6~10ml 裂解液中的GST融合蛋白;
- 在管中加入预冷的200μl PBS(沿壁加入,小心勿剧烈,以免打断珠子与蛋白的联接),轻晃悬浮珠子,将琼脂糖凝胶洗涤一次, 3000rpm离心3min,弃上清;
- 反复三次(最后一次以小枪吸净珠子表面水膜,其余几次可以中枪吸,尽量吸净但不吸走珠子),即获得结合有GST融合蛋白的琼脂糖凝胶;
- 如果用于检测,在谷胱甘肽加入15~20μl 1×蛋白电泳上样缓冲液,在沸水浴中煮3min。12000rpm离心1min,取上清作SDS-PAGE电泳;
- 结合的GST融合蛋白可用谷胱甘肽洗脱缓冲液洗脱;
检测
- 将结合有GST融合蛋白的谷胱甘肽琼脂糖凝胶悬浮在500μlNETN缓冲液中加入20~30μl含有其他蛋白的溶液同时采用结合有GST空蛋白的谷胱甘肽琼脂糖凝胶平行操作作为对照;
- 在水平摇床上,4晃动4~8小时;
- 离心(3600rpm,2min)吸去上清,注意不要扰动底层的琼脂糖球珠;
- 加入200μl缓冲液对琼脂糖凝胶进行洗涤。注意加入缓冲液时要贴壁加,不要直接冲击琼脂糖凝胶,随后轻柔晃
动,使其重悬即可;
- 低速离心(3000rpm,2min)吸去上清,注意不要扰动底层的琼脂糖凝胶;重复步骤的洗涤2~3次;
- 吸干琼脂糖凝胶上方的水层后,加入20~30μl 1×蛋白电泳上样缓冲液,沸水浴4min,冻存于-20℃;
- 做SDS-PAGE和Western检测另一个蛋白;
GST-pull down的对照问题
- 做SDS-PAGE时点一个input的蛋白(即B-6*His)阳性对照,看一下Western操作过程中试剂、操作步骤有没有问题
- 谷胱甘肽琼脂珠上只固定GST蛋白,inputB-6*His,用于做阴性对照,看一下是否GST会与input的蛋白相互作用
相关服务:GST pull-down服务