相关资料:His标签亲和纯化实验步骤(详细)
本文描述了多聚组氨酸标签(His-Tag)融合蛋白使用Ni-IDA/Ni-NTA进行亲和层析的基本原理,优势,以及实验操作流程。
固定化金属离子亲合层析(Immobilized metal ion affinity chromatography, IMAC),简称金属螯合亲合层析,是一种新型的应用于原核蛋白纯化的技术。该方法通过蛋白质表面的一些特殊的氨基酸,使之与金属离子发生相互作用,从而对蛋白质进行亲和纯化。这些作用包括配价键结合、静电吸附、共价键结合等,其中以6个组氨酸残基组合的融合标签(His-Tag)在原核蛋白表达中的应用最为显著。
His-Tag可结合在目的蛋白的C末端或N末端,形成特殊的结构,以便于进行下一步的纯化及检测。由于金属螯合亲合层析具有配体简单、吸附量大、分离条件温和、通用性强等特点,所以可选择范围广,高盐,存在变性剂以及去垢剂的上样条件下进行纯化,His-Tag正逐渐成为分离纯化蛋白质等生物工程产品最有效的技术之一。
His-Tag融合蛋白的适用范围也较广,既可以在非离子型表面活性剂存在的条件下纯化,也可以在变性条件下进行纯化。前者通常用来纯化疏水性强的目的蛋白,而后者则通常纯化包涵体蛋白。
His-Tag可与多种金属离子发生特殊的相互作用,如Ca2+、Mg2+、Ni2+、Cu2+,Fe3+等,其原理是利用蛋白质表面的特性,使之被吸附在凝胶柱上,从而达到分离纯化蛋白的目的。
Ni2+在亲和纯化实验中的使用最为广泛。根据结合基团的不同,Ni2+亲和层析柱可分为俩类——Ni-IDA和Ni-NTA。Ni2+有六个螯合价位,其中Ni-IDA螯合了三价,Ni-NTA螯合了四价。所以IDA的载量要比NTA的高,在同样条件下Ni-IDA洗脱时的咪唑浓度也高于Ni-NTA。但其弱的结合力使金属离子在洗脱阶段时很容易浸出,与目的蛋白紧密结合,从而导致分离蛋白产量偏低,产品不纯及金属离子污染等问题。而NTA的颗粒粒度均匀,粒径更小,并且螯合镍更稳定,能耐受较高的还原剂,使填料更加稳定,镍离子不易脱落。
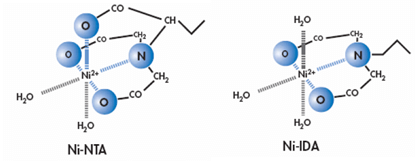
IMAC在通常的情况下是比较稳定的,但螯合剂的存在则会导致其金属离子脱落。例如在E.coli的裂解液中普遍存在一些非特异的弱螯合剂,如在三羧酸循环中产生了二羧酸类物质。因此,E.coli在某些高压情况下就会产生高特异性的金属螯合剂(通常存在于细菌的细胞周质中),导致His-Tag融合蛋白纯化的纯度和产量大大降低。所以在进行纯化His-Tag融合蛋白的实验时,首先需要去除螯合剂。
Ni-NTA分离带His标签的重组蛋白
50mM pH7.4的PBS缓冲液。配制:0.5M NaH2PO4 19ml,0.5M Na2HPO4 81ml,NaCl 29.3g,
加适量水溶解后定容到1000ml。
50mM磷酸盐缓冲液,pH7.4,即pH7.4的PBS溶液。配制:0.5M NaH2PO4 19ml,0.5M Na2HPO4 81ml,NaCl 29.3g和咪唑34g, 加适量,水调pH后定容到1000ml。
不同咪唑浓度的缓冲液B配制:
| 咪唑浓度 | 缓冲液1量(ml) | 缓冲液2量(ml) |
| 10mM | 98 | 2 |
| 50mM | 90 | 10 |
| 100mM | 80 | 20 |
| 200mM | 60 | 40 |
| 300mM | 40 | 60 |
| 400mM | 20 | 80 |
Ni柱中的氯化镍可以与有His-Tag的融合蛋白结合,也可以与咪唑进行结合,当标签蛋白与层析柱表面珠孔内的
镍离子介质发生结合时,不同浓度的咪唑通过层析柱,就会将与镍配位的标签蛋白,杂蛋白等分别洗脱下来,从而得到高纯度目标蛋白。
| 名称 | Ni-IDA | Ni-NTA | |
| 参数 | 指标 | ||
| 基质 | 6%交联琼脂糖凝胶 | ||
| 配基 | 亚胺二乙酸(IDA) | 次氮基三乙酸(NTA) | |
| 粒径 | 45~165 µm | 60~169 µm | |
| 金属离子密度 | 40 µmol/ml | 20-40 µmol/ml | |
| 载量 | 25-30mg蛋白/ml | 15mg蛋白/ml | |
| 柱体积 | 1ml或5ml | 1ml或5ml | |
| 柱尺寸 (内径x高度) |
0.9×1.57cm(1ml柱子) 0.9×1.57cm(5ml柱子) |
0.6cmx2.8cm(1ml柱子) 1.4cmx2.98cm(5ml柱子) |
|
| 推荐流速 | 1ml/min(1ml柱子) 5ml/min(5ml柱子) |
||
| 最高流速 | 4ml/min(1ml柱子) 10ml/min(1ml柱子) |
20ml/min(5ml柱子) 40ml/min(5ml柱子) |
|
| 最高耐压 | 0.3MPa(3bar) | 0.5MPa(5bar) | |
| 避免使用的试剂 | 螯合剂:EDTA、EGTA、柠檬酸等 | >20mM硫化试剂 >10mM DTT 螯合剂:EDTA、EGTA 阴离子去污剂 |
|
| pH稳定性 | PH 2-14(短期,2h);PH 3-12(长期,7天) | ||

亚美体育·(中国)在线登录 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策