聚合酶链式反应(Polymerase Chain Reaction,PCR)是体外合成双链DNA的一种方法,其原理类似于天然DNA的复制过程,其特异性主要依赖于与其目的片段两段互补的特异引物。典型的PCR反应有三个步骤:变性,退火,延伸,经过多次循环反应,获得目的片段。
在PCR的发展历史中,热启动酶的探索发现是制约PCR发展的重要因素,最初被运用到PCR中的酶是大肠杆菌DNA聚合酶I的Klenow片段,Klenow酶每次循环都需重新加入,过程繁琐。此后,科学家成功的从水生嗜热杆菌中提取出耐热的DNA聚合酶,该酶在90℃下反应2小时仍具有70%的活性,这就避免每次循环重新加酶的过程,提高了扩增效率,因此被广泛运用到PCR扩增中。
温度对酶活性的影响表现为双重作用,高温失活,低温抑制。普通的Taq DNA聚合酶的最适温度是72℃,此时酶的活性最佳,小于此温度,酶有较弱活性。这样,在PCR扩增由低温上升至高温的过程中(也就是温度达到变性温度时)酶发挥较弱的活性,体系极易错配或形成引物二聚体,尤其是当设计的引物3’端是G或C,错配的链很难重新解开。因此要提高PCR扩增的特异性和降低反应错配率,可以人为的控制酶的活性,在72℃之前让酶不发挥活性,这样就避免了在升温过程中(或配置反应体系)发生链的错配,从而保证扩增的特异性。Relia热启动酶就是采用化学修饰的方法封闭酶的活性中心:低温下化学小分子和酶活性中心结合,酶无活性,温度升高至95℃,两者脱离,酶活性中心暴露,开始指导体系扩增(如图一),极大的提高扩增的特异性和灵敏度。与抗体封闭的酶相比,化学修饰的酶活性维持更加稳定(抗体封闭是一种动态平衡)且无任何外源DNA污染。
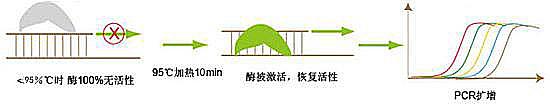
图一:热启动原理
PCR能够快速特异的扩增任何已知的DNA片段,因此被广泛的应用于分子生物学的各个领域。Relia热启动酶因具有5’-3’核酸外切酶活性,可用于荧光定量PCR反应。采用热启动法扩增是提高PCR特异性的常用方法,热启动酶是很好的选择。除此之外,因其具有的高特异性高灵敏度被广泛应用到各个方面:构建cDNA文库,产生大量DNA测序,突变体分的析构建,基因分离,遗传病诊断,法医鉴定等。

亚美体育·(中国)在线登录 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策