 第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于这两部分在空间结构上相对独立,其独特的抗原亲和力保持得很好,但因为有鼠McAb可变区的存在,应用时仍有强烈的HAMA反应。
第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于这两部分在空间结构上相对独立,其独特的抗原亲和力保持得很好,但因为有鼠McAb可变区的存在,应用时仍有强烈的HAMA反应。
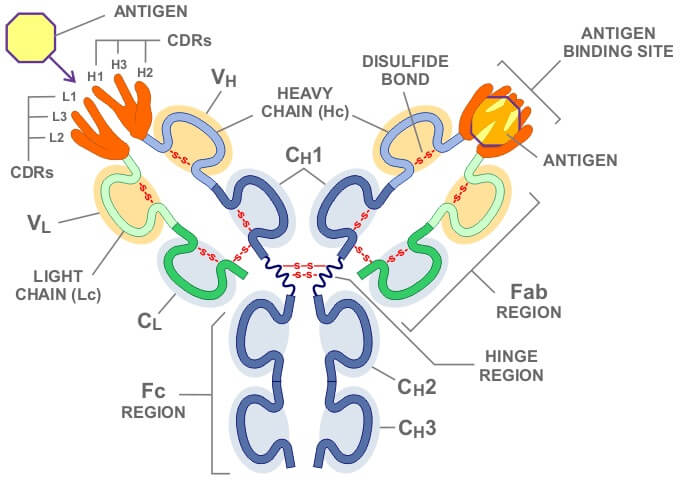
在此基础上,进一步将鼠McAb可变区中相对保守的骨架区(Framework region, FR)换成人的FR,仅仅保留抗原结合部位的互补决定区(Complementarity-determining region, CDR),这才是真正意义上的抗体人源化。但起脚手架作用的FR不仅提供了CDR的空间构象环境,有时还参加抗体结合位点正确构象的形成,甚至参加与抗原的结合。因此,简单的CDR移植往往丧失或降低了原抗体的亲和力。如何在FR中、FR和CDR之间进行操作,目前有四种策略。
使用与鼠对应部分有较大同源性的人抗体FR替换鼠FR,在选择人FR时一般有两条途径。
第一种是对鼠McAb采用同一个(或少数几个)人源FR进行替换。已有晶体结构数据的人源抗体的可变区框架(VH如NEW,KOL,VL如REI等)用作替换的基本模板,借助序列比较与分子模建确定在人、鼠间有种源差异,尤其是鼠FR中与互补决定区CDR有密切作用的氨基酸残基,保留在替换的人源FR中。为了保持CDR的空间构象,要特别注意原来抗体的CDR下面的堆积残基,以及CDR周围的残基。
该途径的优点在于,确切的人源FR晶体结构为残基替换提供了较明确的信息;不足在于不易保持鼠CDR的天然构象,很可能降低或丧失抗体的亲和力。
第二条途径是,在已有的抗体序列库中搜寻与鼠McAb FR有最大同源性的人源FR用以替换。在选择同源的人FR时,先前的工作者倡导将VL和VH作为一个整体来考虑,寻找最高同源的人FR。其理由是同一个抗体的VL和VH在折叠上更能匹配。以后的工作者则认为,将VL和VH分开考虑,分别寻找最高同源的对应序列,更好地保持FR原来的框架,在整体上给鼠CDR提供最类似的环境。总之,同源替换主要考虑的是,鼠CDR在此背景下有类似的折叠环境,从而可保持原来的构象。同样需要分子模建来提供CDR移植后可能或缺的FR关键残基的信息。同源替换的优点是,能减少需要更改的氨基酸数目,更好地保持CDR需要的空间环境;不足的是选择的人源FR可能并无结构数据,不能提供有效的关键残基信息。
对鼠CDR及FR表面残基进行镶饰(veneering)或重塑(resurfacing),以使之类似于人抗体CDR的轮廓(profile)或人FR的型式(pattern)。
表面重塑途径的一个前提是,鼠McAb可变区的免疫原性起源于它的表面残基。因为残基的运动性和溶液可及性是其成为抗原决定簇的基本条件,因此表面残基理应携带全部或绝大部分的抗原表位。溶液可及性表面残基的划分标准是—构成该残基的全部原子的30%以上是溶剂可及的。尽管人、鼠间抗体可变区表面暴露残基的精确型式有差别,但大多数的表面位置的残基类别有强烈的倾向性,仅仅考虑这种表面型式就可分出抗体可变区的组别。这说明抗体可变区表面至少也和框架区核心一样保守,表面型式的差别是人鼠间抗体的主要差别。根据对现有的抗体晶体结构数据的分析结果统计,在序列配对位置上,人、鼠间抗体可变区残基的相对溶剂可及性分布的保真度达98%。这说明在异种间诱导免疫反应的残基是由其余的种特异性溶液可及表面残基引起的。将鼠特异性表面残基换成人源性的,就可模拟人源抗体的表面轮廓,逃避人体免疫系统的识别,达到人源化的目的。该策略可以不进行同源模建,在序列同源分析的基础上,选择与鼠表面残基暴露类型最相匹配的人源型式进行,但不够准确。另外,如果要改变的残基在侧链大小、电荷、疏水性,或有可能形成氢键从而影响到CDR的构象,则不予改变。因为要改变的残基较少,能减少CDR-FR之间的不相容性。
该策略作为较新的一种人源化途径,还在逐步成熟阶段。鼠源McAb在人体引起的HAMA反应,究竟是完全由其表面的暴露残基引起,还是由表面残基与内部残基的共同贡献,涉及到抗体产生最基本的免疫学机制,而这种机制仍是目前探讨的热点。
在人FR选择与CDR有相互作用、与抗体的亲和力有密切关系或对FR空间结构折叠起关键作用的残基进行改变,以补偿完全的CDR移植。
立体结构数据和同源性分析表明:在抗原结合、稳定CDR构象、FR折叠(内部堆积)这几个方面而言,构成抗体FR的残基并不具有相同的重要性。以此为依据将这些残基分成3类:低风险性(low-risk)残基,即暴露于溶剂而对抗原结合和抗体结构贡献甚少的残基。替代这些位置的残基能降低免疫原性而几乎不影响抗体的亲和力;高风险性(high-risk)残基,即直接参与抗原结合、稳定CDR构象或FR折叠的残基。为了保持人源化抗体的活性,应尽量避免在这些位置进行替换。对中度风险性(moderate-risk)残基应谨慎从事。FR中的高风险性残基和某些中度风险性残基,通称为非CDR区补充调控残基(non-CDR complementarity modulating residues)。它们散布于线性序列的不同位置,为每个CDR回折(loop)提供了合适的”平台”。其形状和侧链大小协同决定CDR的基本构象,并影响其抗原结合的特异性。因而将CDR搬到人源FR后,必须将人FR中的这些位置替换成鼠源非CDR区补充调控残基以补偿完全的CDR移植。
这种分析方法使人源化突变方案具有选择性和针对性,避免了盲目的可能导致失败的探索。通过在中度风险性残基中进行变化,还有可能提高人源化抗体的亲和力。不足的是对残基的分类要以晶体数据和三维结构为基础,才能提供准确的标准。
人源化McAb保留了鼠源McAb可变区中参与抗原结合的氨基酸残基,包括CDR和FR中的一些关键残基。尽管鼠框架区的其余部分可以从某个人FR中搬移过来,毫无疑问,这样得到的人源化抗体序列和人抗体的保守序列(consensus sequences)在一些位置上有差别。这些来源于个体型抗体亲和力成熟过程中体细胞突变的非典型残基,应用于病人后会诱导免疫反应。因此,理想的途径是,以人FR保守序列为模板进行人源化。由于人抗体轻、重链可变区不同亚类的保守序列并不相同,需要一种合适的方法来寻找最适保守序列。最简位置模板(minimal positional template)表明,抗体可变区中哪些位置绝对需要保持抗体的抗原结合结构域的完整性,提供了确定关键位置的方法。
在选择人框架区时,首先从现有的人源抗体保守序列中搜寻与鼠框架区最类似的序列;其次根据最简位置模板确定鼠可变区的关键位置残基;最后保留所有这些位置而将其余部分进行人源化。
以上所述人源化的四种策略均以保持抗体的亲和力为核心,以降低免疫原性为目标,各有特点。总之,抗体人源化设计的关键步骤是:
在设计过程中,同源分析和分子模建提供了必需的辅助手段。虽有一些一般性原则,但对某一具体的鼠McAb进行人源化时则必须具体分析。
本文介绍了通过人鼠嵌合抗体重链基因转染小鼠骨髓瘤J558L的研究,较详尽地阐述了用原生质体融合法将重组的人鼠嵌合抗体重链基因转染到J558L骨髓瘤细胞中,并用ELISA法检测转染子的过程和方法。
细胞株:骨髓瘤细胞株J558L,本身能合成免疫球蛋白λ轻链多肽, 但不分泌到细胞外。
供体菌株:E.coli HB101,带有含人鼠嵌合抗体重链基因的pSV2ΔHgptS107VHHuG4质粒。
细胞长生培养基:IMDM + 1%庆大霉素 + 1%制霉菌素 + 10%小牛血清。
H×M:选择培养基 + 次黄嘌呤(0.45ug/ml) + 黄嘌呤0.03mg/ml + 霉酚酸(0.6mg/ml)。
羊抗人IgG:辣根过氧化物酶标的绵羊抗人IgG。
溶菌酶溶液:5mg/ml溶在250mmol/L Tris溶液(PH 8.0)。
PEG-DMSO:47.1% PEG1500-12.5% DMSO-100mmol/L Tris,用DME配制。

亚美体育·(中国)在线登录 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策