免疫组化技术的全称为免疫组织化学技术(Immunohistochemistry,IHC)。
免疫组化于上世纪40年代出现,在60年代后发展迅速,经历了几十年的快速发展,该技术应用范围已覆盖到医学各个学科,已经成为当今生物医学形态、功能、代谢综合研究的一项有力工具。
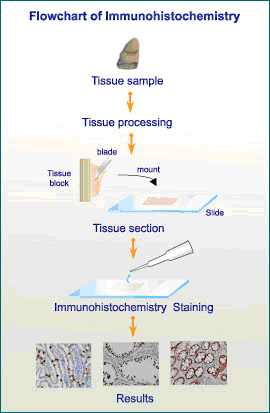
免疫组化,是用标记的特异性抗体对组织内抗原的分布进行定性,定位分析的检测技术。
免疫组化技术原理是:从待检测组织或细胞中提取蛋白作为抗原,通过免疫动物获得特异性抗体,利用抗体探测并结合组织(或细胞)中的抗原。再利用带显色剂标记的二抗检测,对细胞复染显示细胞轮廓,通过显微镜观察,可以实现对组织或细胞内蛋白的定性、定位研究。
免疫组化、Western
Blot、ELISA被称为免疫学三大工具,分别用于定位,定性和定量检测。
| 免疫组化 | Western Blot | ELISA | |
|---|---|---|---|
| 实验原理 | 免疫反应;化学显色反应 | 免疫反应;化学显色反应 | 免疫反应;化学显色反应 |
| 检测样品 | 组织石蜡切片或冰冻切片 | 蛋白 | 血清、细胞、组织培养上清等 |
| 定位检测 | 是 | 否 | 否 |
| 定位检测 | 是 | 是 | 是 |
| 定量检测 | 半定量[1] | 半定量 | 定量检测 |
定位和定性是免疫组化最大的优势。相比于其他蛋白检测方法,免疫组化具有定位较直接准确、定性灵敏度高,是定位检测分析首选方法,尤其对于有些因子的转位研究十分有用。免疫组织化学的临床应用主要包括以下几方面:
近年来,随着免疫组织化学技术的发展和各种特异性抗体的出现,使许多疑难肿瘤得到了明确诊断。免疫组化在肿瘤诊断和鉴别诊断中的实用价值受到了普遍的认可,其在低分化或未分化肿瘤的鉴别诊断时,准确率可达50%-75%。
根据标记物的不同(标记物有荧光染料、放射性同位素、酶、铁蛋白、胶体金等),免疫组化方法可以分为:免疫酶法、免疫荧光法、亲和组织化学法、免疫铁蛋白法、免疫金法及放射免疫自影法等。其中比较常用的是免疫酶法、免疫荧光法、亲和组织化学法,本文以免疫酶法为例,对免疫组化的操作流程做一介绍。
即用型Elivision快速酶免疫组化二步法的孵育及显色流程:一抗+酶标二抗+辣根酶底物显色。
SP法的孵育及显色流程:一抗+生物素二抗+滴加试剂SP(链霉菌抗生物素蛋白-过氧化物酶复合物)+辣根酶底物显色,SP是最常用的实验方法。
ABC法的孵育及显色流程:一抗+生物素二抗+滴加试剂ABC(卵白素-生物素-过氧化物酶复合物)+辣根酶底物显色。
SABC法的孵育及显色流程:一抗+生物素二抗+滴加试剂SABC(链霉卵白素-辣根酶标记生物素复合物)+辣根酶底物显色。
免疫组化实验通常需要设置阳性对照、阴性对照(或替代对照)(阳性对照是排除方法和实验系统有无问题;阴性对照与替代对照是排除有无非特异性染色)。
一般情况下,阳性对照颜色的特点为:Ag定位,包浆、胞核、胞膜、间质具有结构性。且染色的强度不同(颜色深浅不一);阴性对照的特点为:染色细胞与组织无区别,颜色具有弥散性,分布均匀。
| 阳性对照 | 阴性对照 (或替代对照) |
实验组 | 结论 |
|---|---|---|---|
| – | – | – | 操作错误 |
| + | + | + | 非特异性反应 |
| + | + | – | 阴性对照含定位Ag |
| – | – | + | 阳性对照不含定位Ag |
| – | – | + | 受检组织非特异性染色 |
| + | – | + | 受检组织不含定位Ag |
| + | – | + | 受检组织含定位Ag |
注:+表示实验有特异性染色;-表示实验无特异性染色
上表为免疫组化实验中可能出现的结果,由上表可以看出,只有6、7组的实验结果有意义。1~5的实验结果因IHC技术操作存在错误等原因使对照组的实验结果失去对照意义,必须重复实验或者换用Ab。
说明:免疫组化实验可以对结果进行定量分析,但要实验得到的必须是高质量的染色切片,要求背景染色浅且特异性染色较深,这样分析的结果才会比较准确。
 为什么在显微镜下观察发现所有的切片都成阴性?
为什么在显微镜下观察发现所有的切片都成阴性?注释:[1] 半定量是介于定性与定量之间的一种分析方法, 指虽然可以得到一个量值,但是这个量值只能从趋势上进行分析,例如大量、少量、微量、痕量等,而得不到一个具体的数值(例如浓度等)。

亚美体育·(中国)在线登录 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策